Одной из ключевых задач биохимии долгое время оставалась визуализация гликанов — особых углеводных молекул, которые покрывают поверхность клеток. Эти соединения, наряду с белками и нуклеиновыми кислотами, являются одним из трех основных классов биомолекул и играют роль в процессах воспаления и развития заболеваний. Однако ученые, включая биохимика Кэролин Бертоцци из Калифорнийского университета в Беркли, сталкивались с огромными трудностями при попытке наблюдать за ними в реальном времени внутри живых систем, не нарушая их функционирования.
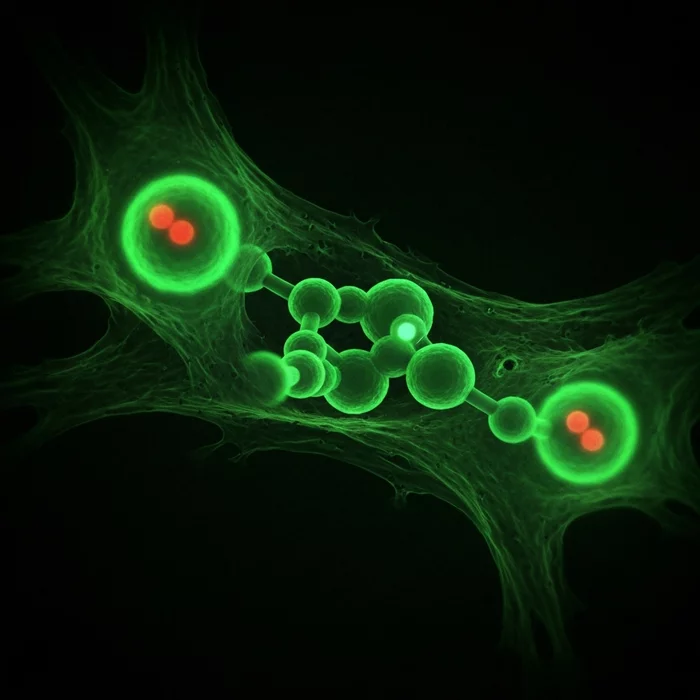
Основы для решения этой проблемы заложили К. Барри Шарплесс из Scripps Research и Мортен Мелдал из Копенгагенского университета, разработавшие концепцию «клик-химии». Традиционный синтез молекул со сложным углеродным каркасом был кропотливым, многоступенчатым процессом, который требовал участия множества ферментов и оставлял после себя нежелательные побочные продукты. Шарплесс предложил радикально упростить задачу: вместо того чтобы строить молекулы с нуля, можно быстро «сщелкивать» их из более мелких, уже готовых субъединиц.
Шарплесс и Мелдал независимо друг от друга открыли ключевую реакцию между двумя химическими соединениями: азидом и алкином. Секретным ингредиентом, который заставлял реакцию работать эффективно, стало добавление меди в качестве катализатора. Этот процесс оказался чрезвычайно мощным и быстрым: реакция протекала с эффективностью более 99,9% и не оставляла побочных продуктов, что открывало новые горизонты для массового производства сложных биомолекул, например, для фармацевтики.
Однако для целей Кэролин Бертоцци, стремившейся наблюдать за процессами внутри живых организмов, этот метод был неприменим. Медь, служащая катализатором, крайне токсична для живых клеток, и ее использование привело бы к их неминуемой гибели. Это означало, что оригинальная «клик-химия» не могла быть использована для визуализации молекул в живой среде.
Бертоцци нашла элегантное решение этой проблемы, модифицировав метод. Основываясь на исследованиях, проведенных десятилетиями ранее, она обнаружила, что азид и алкин вступают в реакцию со взрывной скоростью и без какого-либо катализатора, если придать алкину напряженную кольцевую форму. Этот новый процесс Бертоцци назвала «биоортогональной» химией — термин означает, что реакция протекает внутри живой системы, не вмешиваясь в естественные биологические процессы.
В 2004 году команда Бертоцци продемонстрировала, что этот метод позволяет безвредно присоединять молекулы азида к живым клеткам. Кульминацией стала работа, опубликованная 23 октября 2007 года. В ходе эксперимента ученые внедрили в гликаны живых клеток хомяка углеводную молекулу, модифицированную азидом. Затем они добавили алкин кольцевой формы, связанный с зеленым флуоресцентным белком. Азид и алкин «сщелкнулись», и прикрепленный светящийся белок точно указал на местоположение гликанов внутри клетки.
Разработка Бертоцци стала фундаментальным инструментом в биохимии, открытии лекарств и медицинской визуализации. Ее метод позволил отслеживать гликаны в эмбрионах рыбок данио, наблюдать, как раковые клетки используют молекулы сахара для защиты от атак иммунной системы, а также создавать радиоактивные «трейсеры» для биомедицинской визуализации.
В 2022 году К. Барри Шарплесс, Мортен Мелдал и Кэролин Бертоцци были совместно удостоены Нобелевской премии по химии за их совокупный вклад в развитие клик-химии и биоортогональной химии. Это открытие стоит в одном ряду с другими фундаментальными научными прорывами, такими как изобретение транзистора, открытие «стандартной свечи» Эдвином Хабблом для измерения космических расстояний или первый двухсторонний телефонный звонок по наружным линиям, совершенный Александром Грэмом Беллом.

Изображение носит иллюстративный характер
Основы для решения этой проблемы заложили К. Барри Шарплесс из Scripps Research и Мортен Мелдал из Копенгагенского университета, разработавшие концепцию «клик-химии». Традиционный синтез молекул со сложным углеродным каркасом был кропотливым, многоступенчатым процессом, который требовал участия множества ферментов и оставлял после себя нежелательные побочные продукты. Шарплесс предложил радикально упростить задачу: вместо того чтобы строить молекулы с нуля, можно быстро «сщелкивать» их из более мелких, уже готовых субъединиц.
Шарплесс и Мелдал независимо друг от друга открыли ключевую реакцию между двумя химическими соединениями: азидом и алкином. Секретным ингредиентом, который заставлял реакцию работать эффективно, стало добавление меди в качестве катализатора. Этот процесс оказался чрезвычайно мощным и быстрым: реакция протекала с эффективностью более 99,9% и не оставляла побочных продуктов, что открывало новые горизонты для массового производства сложных биомолекул, например, для фармацевтики.
Однако для целей Кэролин Бертоцци, стремившейся наблюдать за процессами внутри живых организмов, этот метод был неприменим. Медь, служащая катализатором, крайне токсична для живых клеток, и ее использование привело бы к их неминуемой гибели. Это означало, что оригинальная «клик-химия» не могла быть использована для визуализации молекул в живой среде.
Бертоцци нашла элегантное решение этой проблемы, модифицировав метод. Основываясь на исследованиях, проведенных десятилетиями ранее, она обнаружила, что азид и алкин вступают в реакцию со взрывной скоростью и без какого-либо катализатора, если придать алкину напряженную кольцевую форму. Этот новый процесс Бертоцци назвала «биоортогональной» химией — термин означает, что реакция протекает внутри живой системы, не вмешиваясь в естественные биологические процессы.
В 2004 году команда Бертоцци продемонстрировала, что этот метод позволяет безвредно присоединять молекулы азида к живым клеткам. Кульминацией стала работа, опубликованная 23 октября 2007 года. В ходе эксперимента ученые внедрили в гликаны живых клеток хомяка углеводную молекулу, модифицированную азидом. Затем они добавили алкин кольцевой формы, связанный с зеленым флуоресцентным белком. Азид и алкин «сщелкнулись», и прикрепленный светящийся белок точно указал на местоположение гликанов внутри клетки.
Разработка Бертоцци стала фундаментальным инструментом в биохимии, открытии лекарств и медицинской визуализации. Ее метод позволил отслеживать гликаны в эмбрионах рыбок данио, наблюдать, как раковые клетки используют молекулы сахара для защиты от атак иммунной системы, а также создавать радиоактивные «трейсеры» для биомедицинской визуализации.
В 2022 году К. Барри Шарплесс, Мортен Мелдал и Кэролин Бертоцци были совместно удостоены Нобелевской премии по химии за их совокупный вклад в развитие клик-химии и биоортогональной химии. Это открытие стоит в одном ряду с другими фундаментальными научными прорывами, такими как изобретение транзистора, открытие «стандартной свечи» Эдвином Хабблом для измерения космических расстояний или первый двухсторонний телефонный звонок по наружным линиям, совершенный Александром Грэмом Беллом.














